A fizika termodinamikai rendszerek tanulmányozásának egyik fontos kérdése az a kérdés, hogy ez a rendszer képes-e hasznos munkát végezni. A munka fogalmához szorosan kapcsolódik a belső energia fogalma. Ebben a cikkben megvizsgáljuk, hogy mekkora egy ideális gáz belső energiája, és képleteket adunk ennek kiszámításához.
Ideális gáz
A gázról, mint aggregált állapotról, amely külső hatásra nem fejt ki semmilyen rugalmas erőt, és ennek következtében nem tartja meg térfogatát és alakját, minden iskolás tudja. Az ideális gáz fogalma sokak számára továbbra is érthetetlen és tisztázatlan. Magyarázzuk el.
Az ideális gáz minden olyan gáz, amely teljesíti a következő két fontos feltételt:
- Az ezt alkotó részecskéknek nincs mérete. Van méretük, de olyan kicsi a köztük lévő távolságokhoz képest, hogy minden matematikai számításnál figyelmen kívül hagyható.
- A részecskék nem lépnek kölcsönhatásba egymással van der Waals erők vagy erők segítségévelmás természet. Valójában minden valós gázban van ilyen kölcsönhatás, de energiája elhanyagolható a kinetikus részecskék átlagos energiájához képest.
A leírt feltételeket szinte minden valós gáz teljesíti, amelynek hőmérséklete 300 K felett van, nyomásuk pedig nem haladja meg az atmoszférát. Túl magas nyomáson és alacsony hőmérsékleten megfigyeli a gázok eltérését az ideális viselkedéstől. Ebben az esetben valódi gázokról beszélünk. Ezeket a van der Waals egyenlet írja le.
Az ideális gáz belső energiájának fogalma
A definíció szerint egy rendszer belső energiája a rendszerben lévő kinetikai és potenciális energiák összege. Ha ezt a koncepciót egy ideális gázra alkalmazzuk, akkor a potenciális komponenst el kell dobni. Valójában, mivel az ideális gáz részecskéi nem lépnek kölcsönhatásba egymással, abszolút vákuumban szabadon mozgónak tekinthetők. Ahhoz, hogy a vizsgált rendszerből egy részecskét kiemeljünk, nem szükséges a belső kölcsönhatási erők ellen dolgozni, mivel ezek az erők nem léteznek.
Így egy ideális gáz belső energiája mindig egybeesik a mozgási energiájával. Ez utóbbit pedig egyértelműen a rendszer részecskéinek moláris tömege, száma, valamint a transzlációs és forgómozgás átlagos sebessége határozza meg. A mozgás sebessége a hőmérséklettől függ. A hőmérséklet növekedése a belső energia növekedéséhez vezet, és fordítva.
Formula forbelső energia
Jelölje U betűvel az ideális gázrendszer belső energiáját. A termodinamika szerint ez a rendszer H entalpiája és a nyomás és térfogat szorzata közötti különbség, azaz:
U=H - pV.
A fenti bekezdésben azt találtuk, hogy az U értéke megfelel az összes gázrészecske teljes mozgási energiájának Ek:
U=Ek.
A statisztikai mechanikából az ideális gáz molekuláris kinetikai elméletének (MKT) keretein belül az következik, hogy egy részecske átlagos kinetikus energiája Ek1 egyenlő a a következő érték:
Ek1=z/2kBT.
Itt kB és T - Boltzmann-állandó és hőmérséklet, z - szabadsági fokok száma. Az Ek rendszer teljes kinetikus energiáját úgy kaphatjuk meg, hogy Ek1 megszorozzuk a rendszerben lévő N részecskék számával:
Ek=NEk1=z/2NkBT.
Így megkaptuk az ideális gáz belső energiájának képletét, amelyet általános formában írunk le az abszolút hőmérsékletre és a részecskék számára egy zárt rendszerben:
U=z/2NkBT.
Egyatomos és többatomos gáz
A cikk előző bekezdésében leírt U képlet gyakorlati felhasználása szempontjából kényelmetlen, mivel nehéz meghatározni az N részecskék számát. Ha azonban figyelembe vesszük az n anyag mennyiségének meghatározását, akkor ez a kifejezés kényelmesebb formába írható át:
n=N/NA; R=NAkB=8, 314 J/(molK);
U=z/2nR T.
A z szabadsági fokok száma a gázt alkotó részecskék geometriájától függ. Így egy atomos gáznál z=3, mivel egy atom egymástól függetlenül csak a tér három irányában mozoghat. Ha a gáz kétatomos, akkor z=5, mivel a három transzlációs szabadságfokhoz hozzáadódik még két forgási szabadságfok. Végül bármely más többatomos gáz esetén z=6 (3 transzlációs és 3 forgási szabadságfok). Ezt figyelembe véve a következő formában írhatjuk fel egy egyatomos, kétatomos és többatomos ideális gáz belső energiájának képleteit:
U1=3/2nRT;
U2=5/2nRT;
U≧3=3nRT.
Példa a belső energia meghatározására szolgáló feladatra
Egy 100 literes palack 3 atmoszféra nyomású tiszta hidrogént tartalmaz. Feltételezve, hogy a hidrogén adott körülmények között ideális gáz, meg kell határozni, hogy mekkora a belső energiája.

A fenti U képletek tartalmazzák az anyag mennyiségét és a gáz hőmérsékletét. A probléma állapotában ezekről a mennyiségekről egyáltalán nem mondanak semmit. A probléma megoldásához fel kell idézni az univerzális Clapeyron-Mengyelejev egyenletet. Megjelenése az ábrán látható.
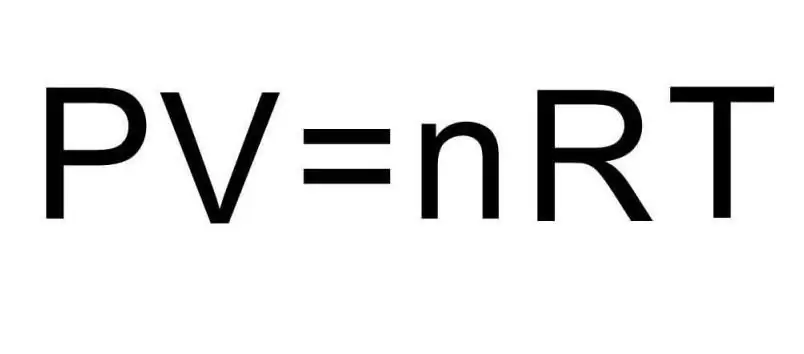
Mivel a hidrogén H2 kétatomos molekula, a belső energia képlete:
UH2=5/2nRT.
A két kifejezést összehasonlítva elérkeztünk a probléma megoldásának végső képletéhez:
UH2=5/2PV.
Még hátra van a nyomás és térfogat mértékegységeinek átszámítása a feltételből az SI mértékegységrendszerbe, a megfelelő értékekkel helyettesítve a képletben UH2 és megkapjuk a válasz: UH2 ≈ 76 kJ.






