A gázokban a két állapot közötti adiabatikus átmenet nem tartozik az izofolyamatok közé, azonban nemcsak a különféle technológiai folyamatokban, hanem a természetben is fontos szerepet játszik. Ebben a cikkben megvizsgáljuk, mi ez a folyamat, és megadjuk az ideális gáz adiabatikus egyenleteit is.
Ideális gáz röviden
Ideális gáz az, amelyben a részecskéi között nincs kölcsönhatás, és méretük nulla. A természetben persze nem léteznek száz százalékig ideális gázok, hiszen mindegyik molekulákból és méretű atomokból áll, amelyek mindig kölcsönhatásba lépnek egymással, legalábbis a van der Waals-erők segítségével. Ennek ellenére a leírt modellt gyakran kellő pontossággal hajtják végre számos valódi gáz gyakorlati problémáinak megoldásához.
Az ideális gáz fő egyenlete a Clapeyron-Mengyelejev törvény. A következő formában van írva:
PV=nRT.
Ez az egyenlet egyenes arányosságot hoz létre a termék közöttP nyomás a V térfogaton és n anyag mennyisége a T abszolút hőmérsékleten. R értéke a gázállandó, amely arányossági tényező szerepét tölti be.
Mi az adiabatikus folyamat?
Az adiabatikus folyamat átmenet a gázrendszer olyan állapotai között, amelyben nincs energiacsere a környezettel. Ebben az esetben a rendszer mindhárom termodinamikai jellemzője (P, V, T) megváltozik, és az n anyag mennyisége állandó marad.
Tegyen különbséget az adiabatikus tágulás és az összehúzódás között. Mindkét folyamat csak a rendszer belső energiájának köszönhető. Tehát a tágulás következtében a rendszer nyomása és főleg hőmérséklete drámaian csökken. Ezzel szemben az adiabatikus kompresszió pozitív hőmérséklet- és nyomásugrást eredményez.
A környezet és a rendszer közötti hőcsere megakadályozása érdekében az utóbbinak hőszigetelt falakkal kell rendelkeznie. Ezenkívül a folyamatidő lerövidítése jelentősen csökkenti a hőáramlást a rendszerbe és onnan.
Poisson-egyenletek egy adiabatikus folyamathoz

A termodinamika első főtétele a következőképpen írható:
Q=ΔU + A.
Más szóval, a rendszerrel közölt Q hőt a rendszer A munka elvégzésére és a belső energiájának ΔU növelésére használja fel. Az adiabatikus egyenlet felírásához Q=0-t kell tenni, ami megfelel a vizsgált folyamat definíciójának. Ezt kapjuk:
ΔU=-A.
Izochorralideális gázban történő folyamat során az összes hő a belső energia növelésére megy el. Ez a tény lehetővé teszi, hogy felírjuk az egyenlőséget:
ΔU=CVΔT.
Ahol CV az izokorikus hőkapacitás. Az A munka pedig a következőképpen kerül kiszámításra:
A=PdV.
Ahol a dV kis hangerő-változást jelent.
A Clapeyron-Mengyelejev egyenlet mellett a következő egyenlet érvényes egy ideális gázra:
CP- CV=R.
Ahol CP az izobár hőkapacitás, amely mindig nagyobb, mint az izochor, mivel figyelembe veszi a tágulásból származó gázveszteségeket.
A fent leírt egyenleteket elemezve és a hőmérsékletet és a térfogatot integrálva a következő adiabatikus egyenlethez jutunk:
TVγ-1=konst.
Itt γ az adiabatikus index. Ez megegyezik az izobár hőkapacitás és az izokhorikus arány arányával. Ezt az egyenlőséget az adiabatikus folyamat Poisson-egyenletének nevezik. A Clapeyron-Mengyelejev törvényt alkalmazva további két hasonló kifejezést írhat, csak a P-T és P-V paramétereken keresztül:
TPγ/(γ-1)=const;
PVγ=konst.
Az adiabatikus gráf különböző tengelyekben adható meg. Alul P-V tengelyekben látható.
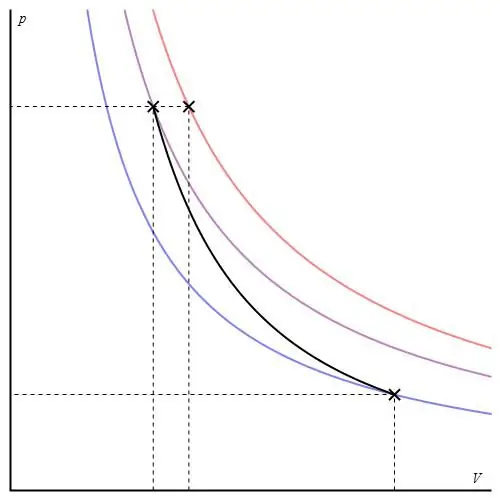
A grafikonon lévő színes vonalak izotermáknak felelnek meg, a fekete görbe egy adiabát. Amint látható, az adiabát élesebben viselkedik, mint bármelyik izoterma. Ez a tény könnyen megmagyarázható: az izoterma esetében a nyomás visszaváltoziktérfogatával arányos, de az izobátnál a nyomás gyorsabban változik, mivel a kitevő γ>1 bármely gázrendszerre.
Példaprobléma
A természetben, hegyvidéken, amikor a légtömeg felfelé halad a lejtőn, nyomása csökken, térfogata megnő és lehűl. Ez az adiabatikus folyamat csökkenti a harmatpontot, és folyékony és szilárd csapadékot termel.

A következő probléma megoldását javasoljuk: a légtömeg felemelése során a hegy lejtőjén a nyomás 30%-kal csökkent a lábánál uralkodó nyomáshoz képest. Mennyi lenne a hőmérséklete, ha a lábánál 25 oC?
A probléma megoldásához használja a következő adiabatikus egyenletet:
TPγ/(γ-1)=konst.
Jobb ebben a formában írni:
T2/T1=(P2/P 1)(γ-1)/γ.
Ha P1 1 atmoszférának vesszük, akkor a P2 0,7 atmoszféra lesz. Levegő esetében az adiabatikus index 1,4, mivel kétatomos ideális gáznak tekinthető. A T1 hőmérsékleti értéke 298,15 K. Mindezeket a számokat a fenti kifejezésbe behelyettesítve T2=269,26 K-t kapunk, ami a következőnek felel meg: - 3, 9 oC.






